Dioxigenil
O ião dioxigenil, O2+, é uma oxidação raramente encontrada em que cada átomo de oxigénio está no estado de oxidação de +1⁄2. Este deriva formalmente do oxigénio molecular do qual foi removido um electrão:
- O2 → O+
2 + e−
À alteração de energia para este processo é designada de energia de ionização da molécula de oxigénio. Em relação à maioria das moléculas, esta energia de ionização é particularmente elevada, perto dos 1175 kJ/mol.[1] Como resultado, o escopo de aplicação da química de
O+
2 é bastante limitado, actuando principalmente como uma 1-electrão oxidante.[2]
Estrutura e propriedades moleculares
editarO
O+
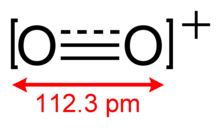
2 apresenta uma ordem de ligação de 2.5, e um comprimento de ligação de 112.3 pm no estado sólido O2[AsF6].[3] Possui o mesmo número de electrões de valência que o óxido nítrico e é paramagnético.[4] A energia de ligação é 625.1 kJ mol-1 e a frequência de estiramento é de 1858 cm-1,[5] sendo que ambos são particularmente altos em relação à maioria das moléculas.
Síntese
editarA reacção do oxigénio, O2, com hexafluoreto de platina, PtF6, produz hexafluoroplatinato de dioxigenil, O2[PtF6]:
- O2 + PtF6 → O+
2[PtF
6]−
O PtF6 é um dos poucos agentes oxidantes capazes de oxidar o oxigénio.
O hexafluoroplatinato de dioxigenil desempenhou um papel fulcral na descoberta de compostos de gases nobres. Depois de Neil Bartlett descobrir que o PtF6 poderia oxidar O2 para O2+, ele investigou a sua reacção com gases nobres e descobriu hexafluoroplatinato de xénon.
O2+ também é encontrado em compostos similares da forma O2MF6, onde M é arsénio (As), antimónio (Sb),[6] ouro (Au),[7] nióbio (Nb), ruténio (Ru), rénio (Re), ródio (Rh),[8] vanádio (V)[9] ou fósforo (P).[10] Outras formas são também aceites, inclusive O2GeF5 e (O2)2SnF6.[9]
Os sais de tetrafluoroborato e hexafluorofosfato podem ser preparados pela reação de difluoreto de dioxigénio com trifluoreto de boro ou pentafluoreto de fósforo a −126 °C:[10]
- 2 O2F2 + 2 BF3 → 2 O2BF4 + F2
- 2 O2F2 + 2 PF5 → 2 O2PF6 + F2
Estes compostos decompõem-se rapidamente à temperatura ambiente:
- 2 O2BF4 → 2 O2 + F2 + 2 BF3
- 2 O2PF6 → 2 O2 + F2 + 2 PF5
Reacções
editarA reacção de O2BF4 com xénona 173 K produz um sólido branco que se acredita ser F–Xe–BF2, contendo uma incomum ligação xénon-boro:[11]
- 2 O2BF4 + 2 Xe → 2 O2 + F2 + 2 FXeBF2
Os sais de dioxigenil O2BF4 e O2AsF6 reagem com monóxido de carbono para dar origem a flureto de oxalilo, C2O2F2, em alto rendimento.[12]
Referências
editar- ↑ Michael Clugston; Rosalind Flemming (2000).
- ↑ Foote, Christopher S.; Valentine, Joan S. (1995). Active oxygen in chemistry. Joel F. Liebman, A. Greenberg. [S.l.]: Springer. ISBN 0-412-03441-7
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997).
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.
- ↑ J. Shamir; J. Binenboym; H. H. Claassen (1968). «The vibrational frequency of the O2+ cation». J. Am. Chem. Soc. 90 (22): 6223–6224. doi:10.1021/ja01024a054
- ↑ A. R. Young; T. Hirata; S. I. Morrow (1964). «The Preparation of Dioxygenyl Salts from Dioxygen Difluoride». J. Am. Chem. Soc. 86 (1): 20–22. doi:10.1021/ja01055a006
- ↑ Nakajima, Tsuyoshi (1995). Fluorine-carbon and fluoride-carbon materials: chemistry, physics, and applications. [S.l.]: CRC Press. ISBN 0-8247-9286-6
- ↑ Vasile, M. J.; Falconer, W. E. (1975). «Vapour transport of dioxygenyl salts». Journal of the Chemical Society Dalton Transactions (4): 316–318. doi:10.1039/DT9750000316
- ↑ a b Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry. [S.l.]: Academic Press. p. 475. ISBN 0-12-352651-5
- ↑ a b Solomon, I. J.; Brabets, R. I.; Uenishi, R. K.; Keith, J. N.; McDonough, J. M. (1964). «New Dioxygenyl Compounds». Inorganic Chemistry. 3 (3). 457 páginas. doi:10.1021/ic50013a036
- ↑ Goetschel, C. T.; Loos, K. R. (1972). «Reaction of xenon with dioxygenyl tetrafluoroborate. Preparation of FXe-BF2». Journal of the American Chemical Society. 94 (9): 3018–3021. doi:10.1021/ja00764a022
- ↑ Pernice, H.; Willner, H.; Eujen, R. (2001). «The reaction of dioxygenyl salts with 13
CO Formation of F13
C(O)13
C(O)F». Journal of Fluorine Chemistry. 112 (2): 277–590. doi:10.1016/S0022-1139(01)00512-7