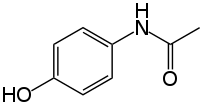
Paracetamol
O paracetamolDCI, também conhecido por acetaminofeno, é um fármaco com propriedades analgésicas e antipiréticas utilizado essencialmente para tratar a febre e a dor leve e moderada,[4] embora existam poucas evidências de que o seu uso seja realmente eficaz no alívio da febre em crianças.[5][6] É geralmente vendido em combinação com outros princípios activos, como nos antitussígenos,[4] ou em medicamentos para o alívio da dor com opiáceos, onde o paracetamol é usado para o alívio da dor severa, como a dor oncológica ou pós-operatória.[7] Geralmente é administrado por via oral embora também esteja disponível para uso por via rectal ou intravenosa, pelo que pode apresentar-se na forma de cápsulas, comprimidos, supositórios ou gotas.[4][8] Os efeitos duram entre duas e quatro horas.[8]
O paracetamol normalmente é seguro sempre que se respeitem as doses recomendadas.[9] Pode ser continuamente utilizado nos pacientes com doenças hepáticas em doses baixas[10] e é seguro durante a gravidez e o período de amamentação.[4] No entanto pode produzir reacções cutâneas graves ou choques anafilácticos (apesar de ser raro isso acontecer) e se em doses elevadas pode provocar insuficiência hepática; uma overdose deste medicamento pode conduzir à morte. O paracetamol é classificado como um analgésico leve[8] e não possui uma significativa actividade anti-inflamatória, e não se sabe ao certo como funciona neste âmbito.[11]
O paracetamol foi descoberto na Alemanha em 1877[12] e é o medicamento mais utilizado para o alívio da dor e da febre na Europa e nos Estados Unidos.[13] Consta na Lista de Medicamentos Essenciais da Organização Mundial de Saúde, considerados os mais eficazes e seguros medicamentos para responder às necessidades dum sistema de saúde.[14] O paracetamol encontra-se disponível como medicamento genérico ou sob diversas marcas comerciais.[15] O preço por atacado nos países em vias de desenvolvimento é inferior a um centavo de dólar (USD) por dose,[16] enquanto que nos países desenvolvidos o seu preço é sensivelmente maior, por exemplo nos Estados Unidos o seu preço ronda os quatro centavos a dose.[17]
História
editarNa Antiguidade e durante o período medieval, os antipiréticos conhecidos eram os compostos presentes na casca do salgueiro-branco (uma família de compostos conhecidos como salicilatos, que deram origem ao conhecido ácido acetilsalicílico) e outros compostos contidos na casca da quina.[18] A cortiça da quina era usada para a obtenção do quinino, composto com actividade antimalárica. O quinino tem também actividade antipirética. Os esforços para isolar a salicilina e o ácido salicílico, tiveram lugar em meados e finais do século XIX, e foi conseguido pelo químico da Bayer, Felix Hoffmann (isto também foi feito pelo químico francês Charles Frédéric Gerhardt quarenta anos antes, mas ele abandonou o trabalho depois de decidir que ele era inviável).[19]
Quando a quina começou a escassear na década de 1880, foi necessário procurar alternativas. Dois agentes antipiréticos foram desenvolvidos nesses anos: a acetanilida em 1886 e a fenacetina em 1887. Nessa altura, o paracetamol tinha sido sintetizado por Harmon Northrop Morse através da redução do p-nitrofenol com o estanho em ácido acético glacial. Isto aconteceu em 1873 (em outras fontes em 1878[20]), mas o paracetamol não foi usado com fins medicinais durante décadas. Em 1893, o paracetamol foi encontrado na urina de pessoas que tinham tomado fenacetina, tendo sido isolado como um composto branco, cristalino e de sabor amargo. Em 1899 o paracetamol foi identificado como sendo um metabolito da acetalinida. Esta descoberta foi ignorada durante algum tempo.
Em 1946 o Instituto para o Estudo de Drogas Analgésicas e Sedativas concedeu uma subvenção ao Departamento de Saúde de Nova Iorque para estudar os problemas associados com o uso de analgésicos. Bernard Brodie e Julius Axelrod, foram designados para investigar a razão pela qual compostos não-aspirina estavam associados com o desenvolvimento da meta-hemoglobinemia, condição clínica originada pela conversão excessiva da hemoglobina em meta-hemoglobina, que é incapaz de transportar oxigénio. Em 1948, ambos os investigadores relacionaram o uso da acetanilida com a meta-hemoglobinemia e deduziram que o seu efeito analgésico era devido ao seu metabolito paracetamol. Propuseram então o uso de paracetamol (acetaminofeno), já que este fármaco não tinha os efeitos tóxicos da acetanilida.[21]
O produto foi pela primeira vez comercializado em 1955 pelos Laboratórios McNeil, pelas ordens do farmacêutico Robert McNeil, como um aliviador de dores e febre para crianças, sob o nome registrado de "Tylenol, Elixir das Crianças".[22] Em 1956, os comprimidos de 500 mg de paracetamol foram também colocados à venda no Reino Unido com o nome comercial "Panadol", produzido por Frederick Stearns & Co, uma filial de Sterling Drug Inc. No início, o Panadol, indicado para o alívio das dores e febre, sem causar irritação gástrica como o ácido acetilsalicílico, só podia ser dispensado aos doentes, mediante a apresentação de uma receita médica. Em Junho de 1958 iniciou-se a comercialização de uma nova forma de apresentação (xarope), o "Elixir Panadol", destinado às crianças. Em 1963, o paracetamol foi adicionado à Farmacopeia Britânica e desde então o seu uso vulgarizou-se como um agente analgésico com poucos efeitos secundários e com poucas interacções medicamentosas.
A patente sobre o paracetamol expirou nos Estados Unidos da América e desde então diversos genéricos ficaram disponíveis no mercado, de acordo com a Ata de Competitividade de Preços e a Lei da Restauração de Patentes, conhecida por "Hatch-Waxman Act" de 1984, ainda que algumas formas farmacêuticas do Tylenol ficassem protegidas até 2007. Nos Estados Unidos, a patente número 6.126.967 de 3 de Setembro de 1998, terminou para todos os tipos de formas de apresentação da substância designada por acetaminofeno.
Química
editarSíntese da molécula
editarA reacção do p-aminofenol com anidrido acético produz a acetilização do primeiro, obtendo-se como produtos da reacção o paracetamol e o ácido acético.[23]
Mecanismo de ação
editarO paracetamol diferencia-se dos AINEs clássicos (anti-inflamatórios não-esteroides), pois, apesar dos seus efeitos analgésicos e antipiréticos, este fármaco não apresenta ações anti-inflamatórias nem anticoagulantes significativas. Adicionalmente, em doses terapêuticas, não origina efeitos gastrointestinais adversos. Apesar de ser um dos analgésicos mais utilizados a nível mundial, o seu mecanismo de ação está pouco elucidado, existindo diversas teorias e argumentos em relação a este tema.[24]
Existem quatro mecanismos propostos, nomeadamente, a inibição da prostaglandina H sintetase, a interação com recetores canabinóides, a interação com recetores serotoninérgicos e, por fim, a inibição da óxido nítrico sintetase.
Prostaglandina H sintetase
editarA via da cicloxigenase (COX) leva à formação de mediadores envolvidos na inflamação, febre, agregação plaquetária e proteção da mucosa do trato gastrointestinal. Nesta via, a enzima prostaglandina H sintetase (PGHS, ou COX) promove a transformação do ácido araquidónico em PGG2, pela COX, e posteriormente em PGH2, pela POX.[25] O paracetamol, devido à sua capacidade redutora, intervém no metabolismo de um substrato importante desta enzima, levando à diminuição da sua ação.[24][26]
Apesar de atuar ao nível da COX, o paracetamol difere dos restantes AINEs, na medida em que a sua ação verifica-se predominantemente a nível do SNC, sendo a sua ação periférica insignificante. Para além disso, não apresenta efeitos anti-inflamatórios nem inibe o tromboxano A2. Estas diferenças justificam-se pelo facto de o paracetamol atuar com maior eficácia em ambientes com baixos níveis de peróxidos e de ácido araquidónico.[24][25][26]
Swierkosz et al. (2002) encontrou evidências de que o paracetamol inibe uma variante da enzima COX, que é diferente das variantes COX-1 e COX-2, denominada agora de Cox-3.[27] No entanto, esta associação apenas foi verificada em cães e não em ratos ou humanos, sendo improvável a sua influência na dor e febre mediada pelas prostaglandinas.[24]
Recetores Canabinóides
editarNo cérebro, o paracetamol pode conjugar-se com o ácido araquidónico, através de uma enzima hidrolase, originando um composto denominado 4-araquidonoilfenolamina (AM404) (Fig. 3). Este composto não atua diretamente nos recetores canabinóides pois tem uma baixa afinidade para eles mas, através de uma ação indireta, leva ao aumento da concentração de canabinóides endógenos e à diminuição de anandamida que levaria à ativação de nociceptores.[24][28]
Recetores Serotoninérgicos
editarVários estudos evidenciam a ação analgésica do paracetamol relaciona-se com a via serotoninérgica descendente, na medida em que potencia a ação da serotonina (5-HT), através de uma interação com os seus recetores.[24][29]
Óxido Nítrico Sintetase
editarO óxido nítrico (NO) é um neurotransmissor produzido em resposta à ativação do recetor NMDA (N-metil-D-aspartato) e responsável pela amplificação da atividade nociceptiva neuronal. Assim, ao inibir a NO sintetase, o paracetamol tem a capacidade de diminuir a perceção da dor.[24]
Metabolismo
editarO paracetamol é metabolizado principalmente no fígado, local onde grande quantidade desta substância converte-se em compostos inactivos, por formação de sulfatos e glicuronídeo, sendo posteriormente excretado pelos rins. Somente uma pequena parte é metabolizada pelo sistema enzimático do citocromo P-450 no fígado.
Os efeitos hepatotóxicos do paracetamol são devidos a um metabolito alquilado menor (a imina N-acetil-p-benzoquinona) e não ao próprio paracetamol ou alguns dos seus metabolitos principais. Este metabolito tóxico reage com grupos sulfidrilos. Em doses normais, é neutralizado rapidamente, combinando-se irreversivelmente com o grupo sulfidrilo do glutatião para produzir um composto não tóxico que é excretado pelos rins.
A eficácia dos tratamentos medicamentosos pode variar muito entre os indivíduos, o que pode levar à diminuição da eficácia ou ao aumento das reações adversas. Grande parte da variação pode ser atribuída à genética, mas fatores ambientais, como estado nutricional, estado da doença e composição bacteriana do intestino, também podem influenciar profundamente.
Toxicidade
editarConsiderações gerais
editarO paracetamol tem um índice terapêutico muito ajustado. Isto significa que a dose normal é próxima da dose em que se considera haver sobredosagem, tornando-o um fármaco relativamente perigoso.[30] Uma única dose de paracetamol de dez gramas ou doses continuadas de cinco gramas/dia em um não consumidor de bebida alcoólica com boa saúde, ou quatro gramas/dia num consumidor habitual de álcool, pode causar danos significativos no fígado. Sem um tratamento adequado, no momento oportuno, a sobredosagem de paracetamol pode originar uma falência hepática seguida de morte em poucos dias.[31][32] Em virtude da fácil aquisição, sem receita médica, o paracetamol é utilizado em muitas tentativas de suicídio.[33]
A FDA (Food and Drug Administration), nos EUA, equivalente à ANVISA, no Brasil: anunciou "em 13/01/2011 que obrigará as indústrias farmacêuticas a produzirem produtos que contenham paracetamol com um limite máximo de 325 mg (miligramas) por comprimido, cápsula ou outro tipo de unidade da dose. A FDA acredita que limitar a quantidade de paracetamol por unidade prescrita pode reduzir o risco de lesão grave ao fígado por dosagem excessiva de paracetamol, um evento adverso que pode levar à falência do fígado, transplante de fígado e morte."[34]
O paracetamol não deve ser tomado quando se consome bebidas alcoólicas, visto que o fígado, quando está a metabolizar o álcool, não pode metabolizar simultaneamente o paracetamol, aumentando, portanto, o risco de hepatotoxicidade. Se usado de uma forma adequada esta substância é um dos tratamentos mais seguros em analgesia. O composto não tem efeitos sobre o sistema da ciclooxigenase, portanto, não tem efeitos negativos sobre o esófago, estômago, intestino delgado ou intestino grosso, ao contrário dos AINEs. Além disso, os doentes com problemas renais podem tomar o paracetamol, enquanto que os AINEs podem provocar insuficiência renal aguda em certos pacientes. Sem contar que o paracetamol não tem o problema da interacção com a maioria dos outros medicamentos.
A potência do analgésico é equivalente, quando não há inflamação, à dos AINEs, sempre que a dose de paracetamol seja a adequada. Um grama diário de paracetamol tem um efeito analgésico equivalente ao dos AINEs, por exemplo, na osteoartrite. Quando administra-se concomitantemente duas vezes ao dia 50 mg de amitriptilina (antidepressivo tricíclico), esta associação é tão eficaz como a associação de paracetamol e codeína, mas não há perda de efeito com o decorrer do tempo, como ocorre com a administração crónica de narcóticos. Uma das grandes diferenças entre o ácido acetilsalicílico e o paracetamol é que com este último não existe o risco de aparecimento da síndrome de Reye em crianças afectadas por doenças virais. Este conjunto de factores fizeram do paracetamol o analgésico de eleição para doentes hospitalizados com problemas de dor suave a moderada. É também o analgésico mais utilizado em ambulatórios.
Além disso, estudos mostraram que o metabolismo redutor da digoxina derivado de micróbios pode alterar a biodisponibilidade do fármaco, levando ao aumento da potencialização do fármaco, resultando em aumento da toxicidade[35].
Mecanismo da toxicidade
editarHepatotoxicidade
editarComo mencionado anteriormente, o paracetamol é metabolizado em compostos inactivos por combinação com sulfato e glicuronídeo, sendo uma pequena parte metabolizada pelo sistema de enzimas citocromo P450. Os citocromos oxidam o paracetamol para produzir uma substância intermediária muito reactiva, a imina N-acetil-p-benzoquinona (NAPQI).[36][37][38] Em condições normais a NAPQI é neutralizada pela acção do glutatião.
Em situações de toxicidade por paracetamol, as vias metabólicas do sulfato e do glicuronídeo ficam saturadas e, portanto, maior quantidade de paracetamol é desviada para o sistema do citocromo P450, onde se produz NAPQI. Consequentemente a quantidade de glutatião é esgotada pela NAPQI, que pode reagir livremente com as membranas celulares. Assim, sendo o NAPQI um composto eletrofílico altamente reativo, vai-se ligar ao grupo cisteína das proteínas formando adutos, causando danos irreversíveis e morte de muitos hepatócitos, levando a necrose hepática aguda.[39][40] Em estudos efectuados em animais, determinou-se que é necessário consumir-se 70% do glutatião hepático antes de ocorrer a hepatotoxicidade.[36]
O sistema imunitário tem um papel igualmente importante, sendo que, os macrófagos reconhecem os hepatócitos danificados, estimulando a libertação de citocinas inflamatórias. Neste ponto, os hepatócitos ser reconhecidos por linfócitos e regenerar ou entrar em apoptose.
Nefrotoxicidade
editarA fisiopatologia da toxicidade renal não está completamente esclarecida, mas é maioritariamente atribuída, tal como acontece na toxicidade hepática, à activação metabólica local do paracetamol pelo citocromo P450 (isoenzima 2E1) e pela consequente reação do metabolito NAPQI com constituintes vitais celulares aí presentes.[41]
No entanto, outros mecanismos foram também identificados como potenciais promotores de nefrotoxicidade, nomeadamente a prostaglandina endoperoxidase sintetase (PGES) presente no rim. Esta enzima liga-se com tão elevada afinidade ao composto, que os metabolitos reativos (mais provavelmente o NAPQI) formam-se mesmo em doses terapêuticas. . Sendo assim, a consequência será a mesma descrita anteriormente: formação de metabolitos tóxicos, ligação covalente a proteínas celulares, seguida de morte celular e necrose tecidual.[42]
Factores de risco
editarSegundo alguns, a dose tóxica de paracetamol é muito variável. Para estas fontes, nos adultos, dose únicas superiores a dez gramas ou 150 mg/kg têm uma razoável probabilidade de causar hepatotoxicidade.[43] Ainda segundo tais fontes, toxicidade poderia também ocorrer quando doses múltiplas menores dentro de 24 horas excederem esses níveis, ou mesmo com a ingestão crônica de doses tão baixas como 4 gramas/dia, e morte com tão baixas como 6 gramas/dia.
Segundo outras fontes, em crianças, doses acima de 200 mg/kg podem potencialmente causar toxicidade. Este limiar mais alto é devido às crianças terem os rins e fígado proporcionalmente maiores ao tamanho do corpo que os adultos e por isso, serem mais tolerantes à superdosagem de paracetamol que os adultos.[44] A sobredosagem involuntária em crianças, raramente origina doença ou morte com as doses crônicas supraterapêuticas sendo a causa principal da toxicidade em crianças.
Em uma dose normal de um grama de acetaminofeno, quatro vezes ao dia, um terço dos pacientes pode ter um aumento em seus testes de função hepática de três vezes o valor normal.[45] Porém, é incerto que isto leve a uma insuficiência hepática.[46]
Entretanto, segundo a FDA (Food and Drug Administration) dos EUA, em boletim oficial de 2011:
- o risco de lesão no fígado ocorre principalmente quando pacientes tomam múltiplas doses, de uma vez, de produtos que contêm paracetamol / acetaminofeno e excedem a dose máxima atual de 4 gramas/dia;[47] ou tomaram mais do que um medicamento contendo paracetamol em 24 horas ou, ainda, que ingeriram bebidas alcoólicas no mesmo período em que tomavam tais medicamentos.[48]
O consumo frequente e excessivo de bebidas alcoólicas, podendo afectar a função renal, pode em consequência disso incrementar a toxicidade do paracetamol. Por esta razão, quando há consumo de álcool, é recomendado o uso de analgésicos alternativos como o ibuprofeno e o ácido acetilsalicílico.
O jejum é um factor de risco, provavelmente devido à redução de reservas do glutatião do fígado. Está bem documentado que, o uso concomitante de inductores do CYP2E1, como a isoniazida, potencia a hepatotoxicidade, ainda que essa relação não esteja bem explicada.[49][50] O alcoolismo crónico, que também provoca a produção de CYP2E1, aumenta portanto também o risco de hepatotoxicidade do paracetamol.[51] No entanto, a toma de paracetamol com uma dose elevada de álcool (não crónica) parece conferir certa protecção à hepatotoxicidade da sobredosagem de paracetamol por inibição do N-acetil-p-benzoquinonaimina, metabolito do paracetamol.[52] A toma em simultâneo de paracetamol com outros medicamentos que induzem a síntese de enzimas CYP, como os antiepilépticos (carbamazepina, fenitoína, barbitúricos, etc) também foram considerados como factores de risco.
Evolução
editarAs pessoas que ingeriram uma sobredosagem de paracetamol, em geral não apresentam sintomas durante as primeiras 24 horas. Os sintomas mais comuns, que aparecem inicialmente e desaparecem ao fim de algumas horas, são: a anorexia, náuseas, vómitos e sudação. Ao tratar-se essa sintomatologia, o doente pode sentir que o pior já passou, no entanto, consoante a dose ingerida, ainda pode aparecer a falência hepática. No caso de uma sobredosagem elevada, pode acontecer o aparecimento de coma e acidose metabólica, mesmo antes da falência hepática.
São os hepatócitos que são afectados à medida que vão metabolizando o paracetamol. Pode também acontecer a insuficiência renal aguda, embora seja mais rara. Isto é geralmente causado por uma falência hepatorenal ou por uma falência orgânica múltipla. A insuficiência renal aguda pode também ser a primeira manifestação clínica de toxicidade. Nestes casos, tem sido sugerido que o metabolito tóxico é produzido em maior quantidade nos rins do que no fígado.
O prognóstico da intoxicação pelo paracetamol varia, dependendo da dose e do tratamento empregado. Em alguns casos, a necrose hepática maciça origina insuficiência hepática fulminante com complicações de hemorragias, hipoglicemia, insuficiência renal, encefalopatia hepática, edema cerebral, septicemia, falência orgânica múltipla e morte dentro de poucos dias. Em muitos casos, a necrose hepática pode correr o seu curso, ou a função hepática pode retornar, e o paciente pode sobreviver com a função hepática retornando ao normal em algumas semanas.
Diagnóstico
editarA evidência de toxicidade hepática poderá desenvolver-se em um prazo de um a quatro dias, embora, em casos graves, pode ser evidente a partir de 12 horas. Podem surgir problemas no quadrante superior direito. Os estudos laboratoriais podem mostrar a evidência de necrose hepática maciça com elevação da AST, ALT, bilirrubina, e tempo de coagulação aumentado (nomeadamente, aumento do tempo da protrombina). Depois de uma sobredosagem de paracetamol, quando AST e ALT excederem os 1000 UI/L, pode ser diagnosticada hepatotoxicidade induzida pelo paracetamol. Contudo a AST e ALT podem exceder 10 000 UI/L. Geralmente a AST é um pouco superior à de ALT na hepatotoxicidade induzida pelo paracetamol.
Usando um nomograma, que foi desenvolvido em 1975, consegue-se calcular o risco de toxicidade baseado-se na concentração sérica de paracetamol num determinado número de horas após a ingestão.[53] Para determinar o potencial risco de hepatotoxicidade, o nível de paracetamol é rastreado ao longo do nomograma padrão. Um nível de paracetamol estabelecido nas primeiras quatro horas após a ingestão pode subestimar o valor no sistema porque o paracetamol pode ainda estar em via de ser absorvido a partir do tracto gastrointestinal. Uma demora da determinação do nível de paracetamol no organismo não é recomendável, devido a que nestes casos as estimativas poderiam não ser adequadas e um nível tóxico, em qualquer momento, é suficiente para administrar o antídoto.
Tratamento
editarPrimeiras acções
editar- Lavagem gástrica
O tratamento inicial não muito complicado para uma sobredosagem é a mesma do utilizado para as overdoses comuns, ou seja, a lavagem gástrica. Adicionalmente administra-se o antídoto, acetilcisteína, por via intravenosa ou oralmente. A absorção do paracetamol pelo trato gastrointestinal está completa ao fim de duas horas em circunstâncias normais. Por este motivo a lavagem gástrica só tem vantagem se for utilizada durante este período. De notar que a velocidade de absorção do paracetamol é ligeiramente diminuída se o fármaco foi ingerido simultaneamente com comida. O médico deve decidir se é suficiente a administração de carvão activado ou se deve proceder também à lavagem gástrica se o acetaminofeno foi ingerido há menos de 60 minutos.[54] O xarope de ipeca, não deve ser utilizado neste caso, porque ao provocar o vómito também expulsa o carbono activado e a acetilcisteína.
- Carvão activado
O carvão activado, ao adsorver o paracetamol, reduz a quantidade absorvida pelo trato gastrointestinal. A administração de carvão activado tem também a vantagem sobre a lavagem gástrica de não permitir a aspiração pulmonar. Inicialmente havia alguma relutância em utilizar o carvão activado, porque este podia também absorver a acetilcisteína. Alguns estudos mostraram que o máximo de acetilcisteína oral que era absorvida na administração concomitante, não ultrapassava os 39%.[55] Outros estudos, indicam que a administração da carvão activado é também benéfico na recuperação clínica do paciente. Tudo leva a crer que há grande vantagem na utilização do carvão activado quando é administrado nas primeiras duas horas após a ingestão do paracetamol.[56] Existem opiniões diversas quanto à dose oral de acetilcisteína a utilizar após a administração do carvão activado.[55][57]
Acetilcisteína
editarA acetilcisteína (também chamada de N-acetilcisteína ou NAC) funciona como antídoto, reduzindo a toxicidade do paracetamol, ao fornecer grupos sulfidrilos (principalmente na forma de glutationa, do qual é um precursor) que neutralizam o metabólito tóxico NAPQI, que assim não pode provocar danos nos hepatócitos e pode ser seguramente excretado. A NAC é comercializada como um suplemento dietético nos Estados Unidos da América.
A eficácia da NAC é bastante significativa se administrada até 8 horas após a intoxicação por paracetamol, mas a partir deste período o seu efeito já é mínimo porque o fígado já começou a sofrer lesões de hepatotoxicidade, aumentando drasticamente a possibilidade de necrose e morte do paciente. Como descrito, quanto mais cedo se administrar a NAC, maiores sãos os benefícios, mas notam-se os seus efeitos benéficos até às 48 horas após a intoxicação.[58] Na prática clínica, se o doente está na situação de intoxicação há mais de oito horas, não se utiliza o carvão activado (por falta de eficácia), mas sim a acetilcisteína. No entanto, quando o médico recebe o doente deve administrar-lhe o carvão activado, enquanto espera os resultados laboratoriais dos níveis de paracetamol.
Nos Estados Unidos, considera-se que o uso de acetilcisteína intravenosa (IV) ou Per os tem uma acção idêntica, no entanto na Austrália e Reino Unido prefere-se a utilização por via IV.
A acetilcisteína na forma IV é dada na dose de 150 mg/kg[59] durante 15 minutos numa solução glicosada (200 mL), seguindo-se durante 4 horas uma concentração de 50 mg/kg numa solução glicosada (500 mL). Nas 16 horas seguintes, é administrada na dose de 100 mg/kg em solução glicosada (1000 mL).
A acetilcisteína Per os é administrada na dose de 140 mg/kg seguida por doses de 70 mg/kg cada 17 horas. A acetilcisteína, na forma oral, nem sempre é bem tolerada, por poder provocar náuseas e vómitos. Por esse motivo pode ser administrada numa solução a 5%, 10% ou 20%. Simultaneamente à administração de acetilcisteína por via IV, pode-se administrar carvão activado no caso de intoxicação múltipla em que algumas substâncias podem interferir com a acetilcisteína.[60]
Medições laboratoriais de bilirrubina, AST ALT e tempo de protrombina, devem ser efectuadas pelo menos uma vez por dia. A acetilcisteína deve continuar a ser administrada mesmo quando já não se detectam níveis de paracetamol no sangue. Durante a falência hepática, a acetilcisteína deve continuar a ser administrada até à melhoria do funcionamento hepático ou então até ao transplante do fígado.
Prognóstico
editarA taxa de mortalidade, provocada pela sobredosagem de paracetamol, aumenta nos dois primeiros dias após a ingestão, atingindo um máximo ao quarto dia, a partir do qual vai gradualmente diminuindo. Os doentes com prognóstico reservado, normalmente acabam por ter a indicação de transplante hepático. A acidose é o indicador mais importante de provável mortalidade e da necessidade de transplante hepático. É referida uma taxa de mortalidade de 95% em doentes não transplantados, que apresentam um pH inferior a 7,30. Os outros indicadores de prognóstico reservado são a insuficiência renal, o grau 3 de encefalopatia hepática, um nítido aumento do tempo de protrombina ou o seu aumento na passagem do terceiro para o quarto dia, após o início da intoxicação. Um estudo mostrou que um nível inferior a 10% do valor normal do factor V é indicativo de fraco prognóstico (91% de mortalidade), enquanto que a taxa de factor VIII / factor V inferior a 30 é indicativo de um bom prognóstico (100% de sobrevivência).[61]
Prevenção
editarAlém da prevenção normal requerida para todas as substâncias, um dos processos para diminuir os riscos da toxicidade pela sobredosagem é a associação de metionina (100 mg) com o paracetamol (500 mg). A metionina ajuda a manter o nível do glutatião no fígado, minimizando, portanto, os danos causados pela sobredosagem de paracetamol.
Segundo Anthony Wong, Chefe do Centro de Assistência Toxicológica (Ceatox) do Hospital das Clínicas de São Paulo[62] 1) "Ao tomar mais de um remédio, primeiro verifique se eles contêm a substância [paracetamol]. Caso contenham, não ultrapasse a margem terapêutica recomendada [segundo a FDA nos EUA, esta é de 4 g / dia].[63] 2) Em segundo lugar, não se pode pensar que o medicamento é seguro só porque é vendido sem prescrição. São remédios como outro qualquer e requerem cuidado. É preciso lembrar que a intoxicação por paracetamol é muito mais frequente do que o que se pensava antigamente. 3) Por último, nunca se deve fazer automedicação, mesmo com remédios de venda livre, principalmente para crianças. O fato de ser de venda livre não reduz em nada os possíveis efeitos danosos." 4)"Além disso, quem ingerir três ou mais doses de bebidas destiladas (como uísque, pinga, vodca, gim) NÃO deve tomar paracetamol."
Interacções
editar- O paracetamol tomado concomitantemente com domperidona ou com metoclopramida, tem a sua absorção aumentada.[64]
- Os anticoagulantes têm o seu efeito aumentado quando o paciente toma regularmente paracetamol.[64]
- Antibióticos como ciprofoxacino, amoxicilina e ampicilina/neomicina pode alterar perfis de excreção do paracetamol.[35]
- Mudanças na microbiota intestinal podem alterar a biodisponiblidade do medicamento e sua farmacocinética[35]
- A interrupção da microbiota, induzida por mudanças na dieta, administração de antibióticos ou patógenos invasivos, pode perturbar o equilíbrio da microbiota e alterar as redes metabólicas. Tais perturbações podem afetar a biodisposição do paracetamol, o que pode levar a reações adversas ao medicamento[35].
Contra indicações
editar- Alguns doentes portadores de favismo podem sofrer hemólise após a ingestão de doses normais de paracetamol.[65]
- Não deve ser associado a Zidovudina, por poder provocar neutropenia.[65]
- O uso do paracetamol durante a gravidez deve ser controlado e apenas quando houver indicação médica. É o que propõe uma Declaração de Consenso, assinada por 13 especialistas e apoiado por 91 cientistas, médicos e profissionais da saúde, publicada na Nature Reviews Endocrinology em 2021[66].
Efeitos nos animais
editarO paracetamol é extremamente tóxico para os gatos e não deve ser administrado em nenhuma situação.[67] Os sintomas iniciais de intoxicação incluem vómitos, salivação, descoloração da língua e gengivas. Cerca de dois dias depois da ingestão de paracetamol, os efeitos nocivos no fígado são bem visíveis, aparecendo a icterícia. Ao contrário do que acontece nos seres humanos, os gatos não morrem pela hepatotoxicidade do paracetamol, mas sim porque em vez da formação de meta-hemoglobina, aparecem os corpos de Heinz nos glóbulos vermelhos, impedindo o aporte de oxigénio às células, acabando por aparecer a hipóxia. O tratamento pode ser possível para doses pequenas, mas deve ser extremamente rápido.
O uso de paracetamol em canídeos também é contra-indicado, embora o grau de toxicidade nestes animais seja menor que nos felinos.[68][69]
Em caso de toma inadevertida em gatos ou overdose em cães, o animal deve ser levado ao veterinário para este proceder à desintoxicação.[70] Os efeitos da intoxicação podem incluir danos ao fígado, anemia hemolítica, danos oxidativos às hemácias e tendências à hemorragia. Não existem remédios caseiros, e os danos irreversíveis ao fígado dependem da rapidez com que é iniciada a intervenção veterinária. O tratamento da overdose de paracetamol pelo veterinário pode envolver o uso de terapia fluida (soro fisiológico), acetilcisteína, metionina ou S-adenosilmetionina (SAMe) para retardar os danos ao fígado e cimetidina para proteger contra a ulceração gástrica. Quando há hepatotoxicidade, não é possível revertê-la.[71]
O paracetamol também é letal para as cobras, e tem sido usado para permitir o controle da espécie Boiga irregularis existente na ilha de Guam.[72]
Outras propriedades
editarUm estudo foi publicado online na revista Psychological Science revelou que os comprimidos de paracetamol e outros medicamentos contra a dor que contêm acetaminofeno podem inibir as emoções de prazer. Estudos anteriores já haviam mostrado que essa medicação tinha um efeito similar com as emoções de pavor.
Um estudo recente demonstrou que o paracetamol (Tylenol) também pode tornar as pessoas insensíveis a emoções positivas e negativas.[73]
Um estudo da Universidade de Toronto sugere que a ingestão de paracetamol pode prejudicar a sua capacidade de tomar decisões e identificar erros. Para a realização do estudo, foram analisados 62 voluntários – metade ingeriu 1 grama de paracetamol e os restantes tomaram apenas placebo. Depois, todos tiveram de executar as mesmas tarefas: carregar num botão quando a letra F aparecesse e não pressionar caso o o ecrã mostrasse a letra E. O grupo que tomou paracetamol não só carregou mais vezes no botão quando aparecia a letra E, como deixaram passar várias vezes a letra F sem pressionar o dispositivo.[74]
Ver também
editarReferências
- ↑ Karthikeyan, M.; Glen, R. C.; Bender, A. (2005). «General Melting Point Prediction Based on a Diverse Compound Data Set and Artificial Neural Networks». Journal of Chemical Information and Modeling. 45 (3): 581–590. PMID 15921448. doi:10.1021/ci0500132
- ↑ «melting point data for paracetamol». Lxsrv7.oru.edu. Consultado em 19 de março de 2011. Arquivado do original em 30 de junho de 2012
- ↑ Granberg, R. A.; Rasmuson, A. C. Solubility of paracetamol in pure solvents. J. Chem. Eng. Data, v. 44, n. 6, p. 1391-1395, 1999. Disponível em:<http://pubs.acs.org/cgi-bin/abstract.cgi/jceaax/1999/44/i06/abs/je990124v.html>. Acesso em: 06 Jan 2008. doi: 10.1021/je990124v.
- ↑ a b c d «Acetaminophen». The American Society of Health-System Pharmacists. Consultado em 16 de setembro de 2016. Cópia arquivada em 5 de junho de 2016
- ↑ Meremikwu, M; Oyo-Ita, A (2002). «Paracetamol for treating fever in children». The Cochrane Database of Systematic Reviews (2): CD003676. PMID 12076499. doi:10.1002/14651858.CD003676
- ↑ De Martino, Maurizio; Chiarugi, Alberto (2015). «Recent Advances in Pediatric Use of Oral Paracetamol in Fever and Pain Management». Pain and Therapy. 4 (2): 149–168
- ↑ Scottish Intercollegiate Guidelines Network (SIGN) (2008). «6.1 and 7.1.1». Guideline 106: Control of pain in adults with cancer (PDF). Scotland: National Health Service (NHS). ISBN 9781905813384. Cópia arquivada (PDF) em 20 de dezembro de 2010
- ↑ a b c Hochhauser, Daniel (2014). Cancer and its Management. [S.l.]: John Wiley & Sons. p. 119. ISBN 9781118468715. Cópia arquivada em 8 de setembro de 2017
- ↑ Russell, FM; Shann, F; Curtis, N; Mulholland, K (2003). «Evidence on the use of paracetamol in febrile children». Bulletin of the World Health Organization. 81 (5): 367–72. PMC 2572451 . PMID 12856055
- ↑ Lewis, JH; Stine, JG (junho de 2013). «Review article: prescribing medications in patients with cirrhosis - a practical guide». Alimentary pharmacology & therapeutics. 37 (12): 1132–56. PMID 23638982. doi:10.1111/apt.12324
- ↑ McKay, Gerard A.; Walters, Matthew R. (2013). «Non-Opioid Analgesics». Lecture Notes Clinical Pharmacology and Therapeutics 9th ed. Hoboken: Wiley. ISBN 9781118344897. Cópia arquivada em 8 de setembro de 2017
- ↑ Mangus, Brent C.; Miller, Michael G. (2005). Pharmacology application in athletic training. Philadelphia, Pennsylvania: F.A. Davis. p. 39. ISBN 9780803620278. Cópia arquivada em 8 de setembro de 2017
- ↑ Aghababian, Richard V. (22 de outubro de 2010). Essentials of emergency medicine. [S.l.]: Jones & Bartlett Publishers. p. 814. ISBN 978-1-4496-1846-9. Cópia arquivada em 17 de agosto de 2016
- ↑ «WHO Model List of Essential Medicines (19th List)» (PDF). World Health Organization. Abril de 2015. Consultado em 8 de dezembro de 2016. Cópia arquivada (PDF) em 13 de dezembro de 2016
- ↑ Hamilton, Richard J. (2013). Tarascon pocket pharmacopoeia : 2013 classic shirt-pocket edition 27th ed. Burlington, Massachusetts: Jones & Bartlett Learning. p. 12. ISBN 9781449665869. Cópia arquivada em 8 de setembro de 2017
- ↑ «Paracetamol». Consultado em 11 de janeiro de 2016
- ↑ «Acetaminophen prices, coupons and patient assistance programs». Consultado em 19 de fevereiro de 2016. Cópia arquivada em 16 de fevereiro de 2016
- ↑ Gormley, James J. (Março de 1996). «White willow bark is a gentle, effective pain-reliever». Better Nutrition. Consultado em 2 de novembro de 2007
- ↑ «A história da Aspirina». Did You Know?. Consultado em 2 de novembro de 2007
- ↑ Merck index 11ª edição
- ↑ Brodie BB, Axelrod J (1948). «The fate of acetanilide in man» (PDF). J Pharmacol Exp Ther. 94 (1): 29–38
- ↑ «Um Festival de Analgésicos». Chemical Heritage Foundation. Consultado em 3 de novembro de 2007. Arquivado do original em 15 de junho de 2010
- ↑ Thomas Christoph; Helmut Buschmann (2002). «Cyclogenase inhibition: From NSAIDs to selective COX-2 inhibitors». In: Bernd Sundermann; Helmut Buschmann; Thomas Christoph; Elmar Friderichs; Corinna Maul. Analgesics: From Chemistry and Pharmacology to Clinical Application. Weinheim: Wiley-VCH. pp. 13–126. ISBN 3-527-30403-7
- ↑ a b c d e f g Anderson, B.J., Paracetamol (Acetaminophen): mechanisms of action. Paediatr Anaesth, 2008. 18(10): p. 915-21.
- ↑ a b Toussaint, K., et al., What do we (not) know about how paracetamol (acetaminophen) works? J Clin Pharm Ther, 2010. 35(6): p. 617-38.
- ↑ a b Smith, H.S., Potential analgesic mechanisms of acetaminophen. Pain Physician, 2009. 12(1): p. 269-80.
- ↑ Swierkosz TA, Jordan L, McBride M, McGough K, Devlin J, Botting RM (2002). "Actions of paracetamol on cyclooxygenases in tissue and cell homogenates of mouse and rabbit". Med Sci Monit 8 (12): BR496-503. PMID PDF.
- ↑ Mallet, C., et al., Endocannabinoid and serotonergic systems are needed for acetaminophen-induced analgesia. Pain, 2008. 139(1): p. 190-200.
- ↑ Pickering, G., et al., Analgesic effect of acetaminophen in humans: First evidence of a central serotonergic mechanism. Clinical Pharmacology & Therapeutics, 2006. 79(4): p. 371-378.
- ↑ Martindale, Pharmaceutical Press, 2004. CD nº34. MedicinesComplete Browser (version 1.1.1707.18094).
- ↑ Larson AM, Polson J, Fontana RJ; et al. (2005). «Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study». Hepatology. 42 (6): 1364–72. PMID 16317692. doi:10.1002/hep.20948
- ↑ Ryder SD, Beckingham IJ (2001). «ABC of diseases of liver, pancreas, and biliary system. Other causes of parenchymal liver disease». BMJ. 322 (7281): 290–92. PMID 11157536. doi:10.1136/bmj.322.7281.290 [11157536 Free full text]
- ↑ Sheen C, Dillon J, Bateman D, Simpson K, Macdonald T (2002). «Paracetamol toxicity: epidemiology, prevention and costs to the health-care system». QJM. 95 (9): 609–19. PMID 12205339
- ↑ http://www.fda.gov/Drugs/DrugSafety/InformationbyDrugClass/ucm165107.htm
- ↑ a b c d Malfatti, Michael A.; Kuhn, Edward A.; Murugesh, Deepa K.; Mendez, Melanie E.; Hum, Nicholas; Thissen, James B.; Jaing, Crystal J.; Loots, Gabriela G. (12 de março de 2020). «Manipulation of the Gut Microbiome Alters Acetaminophen Biodisposition in Mice». Scientific Reports (em inglês) (1). 4571 páginas. ISSN 2045-2322. doi:10.1038/s41598-020-60982-8. Consultado em 10 de julho de 2023
- ↑ a b Richardson, J.A. Management of acetaminophen and ibuprofen toxicoses in dogs and cats. J Vet Emerg Crit Care. 2000; 10: 285–291.
- ↑ Rumbeiha, W.K.; Lin, Y.S.; Oehme, F.W. Comparison of N-acetylcysteine and methylene blue, alone or in combination, for treatment of acetaminophen toxicosis in cats. Am J Vet Res. 1995; 56: 1529–1533.
- ↑ Sellon, R.K. Acetaminophen. In: Peterson ME, Talcott PA, eds. Small Animal Toxicology. Toronto: WB Saunders, 2001: 388–395.
- ↑ Timbrell, J., Principles of Biochemical Toxicology. 4th ed. 2009, New York: Informa Healthcare. 313-321.
- ↑ Rannug, U., et al., An evaluation of the genetic toxicity of paracetamol. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1995. 327(1–2): p. 179-200.
- ↑ Thomas, S.H., Paracetamol (acetaminophen) poisoning. Pharmacol Ther, 1993. 60(1): p. 91-120.
- ↑ Bessems, J.G.M. and N.P.E. Vermeulen, Paracetamol (Acetaminophen)-Induced Toxicity: Molecular and Biochemical Mechanisms, Analogues and Protective Approaches. Critical Reviews in Toxicology, 2001. 31(1): p. 55-138.
- ↑ Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, Caravati EM, Wax PM, Keyes DC, Woolf AD, Scharman EJ, Booze LL, Troutman WG; American Association of Poison Control Centers (2006). «Acetaminophen poisoning: an evidence-based consensus guideline for out-of- hospital management». Clin Toxicol (Phila). 44 (1): 1–18. PMID 16496488
- ↑ Tenenbein M (2004). «Acetaminophen: the 150 mg/kg myth». J Toxicol Clin Toxicol. 42 (2): 145–48. PMID 15214618
- ↑ Watkins PB, Kaplowitz N, Slattery JT; et al. (2006). «Aminotransferase elevations in healthy adults receiving 4 grams of acetaminophen daily: a randomized controlled trial». JAMA. 296 (1): 87–93. PMID 16820551. doi:10.1001/jama.296.1.87
- ↑ Dart RC, Bailey E (2007). «Does therapeutic use of acetaminophen cause acute liver failure?». Pharmacotherapy. 27 (9): 1219–30. PMID 17723075. doi:10.1592/phco.27.9.1219
- ↑ FDA News Release, 2011. FDA limits acetaminophen in prescription combination products; requires liver toxicity warnings The risk of liver injury primarily occurs when patients take multiple products containing acetaminophen at one time and exceed the current maximum dose of 4,000 milligrams within a 24-hour period.
- ↑ FDA News Release, 2011. FDA limits acetaminophen in prescription combination products; requires liver toxicity warnings Most of the cases of severe liver injury occurred in patients who took more than the prescribed dose of an acetaminophen-containing product in a 24-hour period, took more than one acetaminophen-containing product at the same time, or drank alcohol while taking acetaminophen products.
- ↑ Crippin JS (1993). "Acetaminophen hepatotoxicity: potentiation by isoniazid". Am J Gastroenterol 88 (4): 590-2. PMID
- ↑ Nolan CM, Sandblom RE, Thummel KE, Slattery JT, Nelson SD (1994). "Hepatotoxicity associated with acetaminophen usage in patients receiving multiple drug therapy for tuberculosis". Chest 105 (2): 408-11. PMID
- ↑ Zimmerman HJ, Maddrey WC (1995). "Acetaminophen (paracetamol) hepatotoxicity with regular intake of alcohol: analysis of instances of therapeutic misadventure". Hepatology 22 (3): 767-73. PMID
- ↑ «CIM» (PDF)[ligação inativa]
- ↑ Rumack B, Matthew H (1975). «Acetaminophen poisoning and toxicity». Pediatrics. 55 (6): 871–76. PMID 1134886
- ↑ Vale JA, Kulig K; American Academy of Clinical Toxicology; European Association of Poisons Centres and Clinical Toxicologists (2004). «Position paper: gastric lavage». J Toxicol Clin Toxicol. 42 (7): 933–43. PMID 15641639
- ↑ a b Ekins B, Ford D, Thompson M, Bridges R, Rollins D, Jenkins R (1987). «The effect of activated charcoal on N-acetylcysteine absorption in normal subjects». Am J Emerg Med. 5 (6): 483–87. PMID 3663288
- ↑ Buckley NA, Whyte IM, O'Connell DL, Dawson AH. (1999). «Activated charcoal reduces the need for N-acetylcysteine treatment after acetaminophen (paracetamol) overdose». J Toxicol Clin Toxicol. 37 (6): 753–57. PMID 10584587
- ↑ Spiller H, Krenzelok E, Grande G, Safir E, Diamond J (1994). «A prospective evaluation of the effect of activated charcoal before oral N-acetylcysteine in acetaminophen overdose». Ann Emerg Med. 23 (3): 519–23. PMID 8135427
- ↑ Keays R, Harrison P, Wendon J, Forbes A, Gove C, Alexander G, Williams R (1991). «Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial». BMJ. 303 (6809): 1026–9. PMID 1954453
- ↑ «Prontuário Terapêutico (Infarmed)» 🔗[ligação inativa]
- ↑ Buckley N, Whyte I, O'Connell D, Dawson A (1999). «Oral or intravenous N-acetylcysteine: which is the treatment of choice for acetaminophen (paracetamol) poisoning?». J Toxicol Clin Toxicol. 37 (6): 759–67. PMID 10584588
- ↑ Pereira LM, Langley PG, Hayllar KM, Tredger JM, Williams R (1992). «Coagulation factor V and VIII/V ratio as predictors of outcome in paracetamol induced fulminant hepatic failure: relation to other prognostic indicators». Gut. 33 (1): 98–102. PMID 1740285
- ↑ Anthony Wong, 2001. O risco dos analgésicos. http://www.istoe.com.br/assuntos/entrevista/detalhe/38153_O+RISCO+DOS+ANALGESICOS
- ↑ http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm239894.htm
- ↑ a b «Prontuário Terapêutico online». Arquivado do original em 7 de janeiro de 2009
- ↑ a b «ANF» (PDF)
- ↑ «Paracetamol: grávidas devem tomar apenas sob orientação médica, alertam especialistas»
- ↑ Allen AL (2003). «The diagnosis of acetaminophen toxicosis in a cat». Can Vet J. 44 (6): 509–10. PMID 12839249
- ↑ «Paracetamol – Veneno para o seu animal». Clinacão. Consultado em 3 de abril de 2013[ligação inativa]
- ↑ «Analgesics (Toxicity)». The Merck Veterinary Manual. Março de 2012. Consultado em 4 de abril de 2013
- ↑ Villar D, Buck WB, Gonzalez JM (1998). «Ibuprofen, aspirin and acetaminophen toxicosis and treatment in dogs and cats». Vet Hum Toxicol. 40 (3): 156–62. PMID 9610496
- ↑ Manning AM. «Acetaminophen Toxicity in Dogs». PetPlace.com. Consultado em 5 de novembro de 2007
- ↑ Johnston J, Savarie P, Primus T, Eisemann J, Hurley J, Kohler D (2002). «Risk assessment of an acetaminophen baiting program for chemical control of brown tree snakes on Guam: evaluation of baits, snake residues, and potential primary and secondary hazards». Environ Sci Technol. 36 (17): 3827–33. PMID 12322757
- ↑ «Paracetamol não inibe apenas a dor, mas também as emoções, aponta estudo»
- ↑ «Paracetamol pode estar a afetar a sua vida sem que dê conta». Arquivado do original em 15 de abril de 2016
Ligações externas
editar- «Visão geral do acetaminofeno em Epocrates Online» (em inglês)
- «Acetaminofeno na WikiTox Ensino de Toxicologia» (em inglês)
- «Centro de informação sobre o paracetamol» (em inglês)
- «História do paracetamol» (em inglês)
- «História e química do paracetamol» (em inglês)
- «Toxicidade do paracetamol e outros AINEs» (em inglês)
- «Trabalhos de Julius Axelrod» (em inglês)
- «Sobredosagem de paracetamol em crianças» (em inglês)
- «Hepatotoxicidade do paracetamol» (em inglês)
- «Lista de medicamentos que contêm paracetamol» (em francês)
- «Ficha do paracetamol em BIAM.org» (em francês)
- «Toxicidade do paracetamol e comunicação de risco» (em português)