Síntese de Friedländer
A síntese de Friedländer é uma reação química de 2-aminobenzaldeído[1] com cetonas para formar derivados de quinolina.[2][3] Seu nome é uma homenagem ao químico alemão Paul Friedländer (1857–1923).
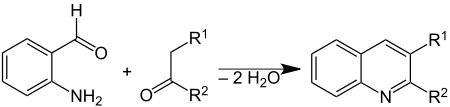
Essa reação pode ser catalisada por ácido trifluoroacético,[4] ácido toluenossulfônico,[5] iodo[6] e outros ácidos de Lewis.[7]
Mecanismo
editarExistem dois mecanismos de reação viáveis para essa reação. No primeiro mecanismo, o composto carbonílico 2-aminossubstituído 1 e o composto carbonílico 2 reagem numa adição aldólica (etapa limitante da velocidade reacional) para formar o aldol 3. O intermediário perde água em uma reação de eliminação, formando o composto carbonílico insaturado 4 (o que, junto da adição aldólica, constitui uma condensação aldólica). Depois, este perde água novamente na formação da quinolina 7. No segundo mecanismo, a primeira etapa é a formação da base de Schiff 5, seguida da adição aldólica para formar 6 e da eliminação para formar 7.[11]
A reação de Pfitzinger e a síntese de quinolina de Niementowski são variações da reação de Friedländer.
Ver também
editarReferências
- ↑ Horning, E. C. (1955). Organic Synthesis Collective Volume 3. [S.l.: s.n.] p. 56. doi:10.1021/ED032P388.1
- ↑ Friedländer, P. (1882). «Ueber o-Amidobenzaldehyd». Chemische Berichte. 15 (2): 2572–2575. doi:10.1002/cber.188201502219
- ↑ Gohring, C. F. (1883). «Ueber eine Darstellungsmethode im Pyridinkern substituirter Chinolinderivate». Chemische Berichte. 16 (2): 1833–1839. doi:10.1002/cber.18830160265
- ↑ Shaabani, A.; Soleimani, E.; Badri, Z. (2007). «Trifluoroacetic Acid as an Efficient Catalyst for the Synthesis of Quinoline». Synthetic Communications. 37 (4): 629–635. doi:10.1080/00397910601055230
- ↑ Jia, C. S.; Zhang, Z.; Tu, S. J.; Wang, G. W. (2006). «Rapid and efficient synthesis of poly-substituted quinolines assisted by p-toluene sulphonic acid under solvent-free conditions: Comparative study of microwave irradiation versus conventional heating». Org. Biomol. Chem. 4 (1): 104–110. PMID 16358003. doi:10.1039/b513721g
- ↑ Wu, J.; Xia, H. G.; Gao, K. (2006). «Molecular iodine: A highly efficient catalyst in the synthesis of quinolines via Friedländer annulation». Org. Biomol. Chem. 4 (1): 126–129. PMID 16358006. doi:10.1039/b514635f
- ↑ Varala, R.; Enugala, R.; Adapa, S. R. (2006). «Efficient and Rapid Friedlander Synthesis of Functionalized Quinolines Catalyzed by Neodymium(III) Nitrate Hexahydrate». Synthesis. 2006 (22): 3825–3830. doi:10.1055/s-2006-950296
- ↑ Manske, R. H. (1942). «The Chemistry of Quinolines». Chem. Rev. 30: 113–144. doi:10.1021/cr60095a006
- ↑ Bergstrom, F. W. (1944). «Heterocyclic Nitrogen Compounds. Part IIA. Hexacyclic Compounds: Pyridine, Quinoline, and Isoquinoline». Chem. Rev. 35 (2): 77–277. doi:10.1021/cr60111a001
- ↑ Cheng, C. C.; Yan, S. J. (2004). «The Friedländer Synthesis of Quinolines». Organic Reactions. [S.l.: s.n.] ISBN 0471264180. doi:10.1002/0471264180.or028.02
- ↑ Marco-Contelles, José; Perez-Mayoral, Elena; Samadi, Abdelouahid; Carreiras, Maria do Carmo; Soriano, Elena (2009). «Recent Advances in the Friedlander Reaction». Chemical Reviews. 109 (6): 2652–71. PMID 19361199. doi:10.1021/cr800482c