Trióxido de tungsténio
Óxido de tungsténio (VI) também conhecido como trióxido de tungsténio ou anidrido túngstico, WO3, é um composto químico contendo oxigénio e o metal de transição tungsténio. É obtido durante a recuperação do tungsténio a partir dos seus minerais.[1] Os minérios de tungsténio são tratados com alcalis para produzir WO3. Reações adicionais com carbono ou gás hidrogénio reduzem o trióxido de tungsténio a metal puro.
- 2 WO3 + 3 C + calor → 2 W + 3 CO2
- WO3 + 3 H2 + calor → W + 3 H2O
O óxido de tungsténio (VI) ocorre naturalmente na forma de hidratos, incluindo minerais: tungstite WO3·H2O, meymacite WO3·2H2O e hidrotungstite (com a mesma composição da meymacite, contudo por vezes escrita como H2WO4). Estes minerais são minerais secundários de tungsténio raros a muito raros.
História
editarO tungsténio tem uma história rica que remonta até à sua descoberta durante o século XVIII. Peter Woulfe foi o primeiro a reconhecer um novo elemento no mineral volframite. O químico sueco Carl Wilhelm Scheele contribuiu também para a sua descoberta com os seus estudos sobre o mineral scheelite.[1]
Em 1841, um químico chamado Robert Oxland forneceu os primeiros procedimentos para a preparação de trióxido de tungsténio e tungstato de sódio.[2] Foram-lhe concedidas patentes pelo seu trabalho, e é considerado o fundador da química sistemática do tungsténio.[2]
Preparação
editarO trióxido de tungsténio pode ser preparado de várias formas diferentes. Deixa-se reagir CaWO4, ou scheelite, com ácido clorídrico para produzir ácido túngstico, que se decompõe em WO3 e água a altas temperaturas.[1]
- CaWO4 + 2 HCl → CaCl2 + H2WO4
- H2WO4 + calor → H2O + WO3
Outra forma comum de sintetizar WO3 é por calcinação do paratungstato de amónio sob condições oxidantes:[2]
- (NH4)10[H2W12O42]•4H2O → 12 WO3 + 10 NH3 + 11 H2O
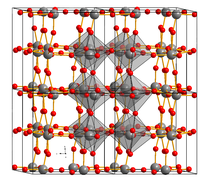
Estrutura
editarA estrutura cristalina do trióxido de tungsténio depende da temperatura. É tetragonal a temperaturas superiores a 740 °C, ortorrômbica entre os 330 e os 740 °C, monoclínica dos 17 aos 330 °C, e triclínica entre os -50 e os 17 °C. A estrutura mais comum de WO3 é a monoclínica com grupo espacial P21/n.[2]
Usos
editarO trióxido de tungsténio tem muitas aplicações quotidianas. É frequentemente usado na indústria para fabricar tungstatos para tecidos à prova de fogo[3] e em detectores de gases.[4] Devido à sua intensa cor amarela, WO3 é também usado como pigmento em cerâmica e tintas.[1]
Nos últimos anos, o trióxido de tungsténio tem sido usado na produção de janelas eletrocrómicas ou janelas inteligentes. Estas janelas podem variar as propriedades de transmissão da luz quando lhes é aplicada uma diferença de potencial.[5] Tal permite ao utilizador escurecer as janelas, alterando a quantidade de calor ou luz que as atravessa.
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Tungsten trioxide», especificamente desta versão.
Referências
- ↑ a b c d Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. [S.l.]: McGraw-Hill. ISBN 0070494398. Consultado em 6 de junho de 2009
- ↑ a b c d Lassner, Erik and Wolf-Dieter Schubert (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. New York: Kluwer Academic. ISBN 0306450534
- ↑ "Tungsten trioxide." The Merck Index Vol 14, 2006.
- ↑ David E Williams et al, "Modelling the response of a tungsten oxide semiconductor as a gas sensor for the measurement of ozone", Meas. Sci. Technol. 13 923, doi: 10.1088/0957-0233/13/6/314
- ↑ Lee, W. J. (2000). «Effects of surface porosity on tungsten trioxide(WO3) films' electrochromic performance». Journal of Electronic Materials. 29. 183 páginas. doi:10.1007/s11664-000-0139-8
|nome2=sem|sobrenome2=em Authors list (ajuda);|nome3=sem|sobrenome3=em Authors list (ajuda);|nome4=sem|sobrenome4=em Authors list (ajuda);|nome5=sem|sobrenome5=em Authors list (ajuda);|nome6=sem|sobrenome6=em Authors list (ajuda);|nome7=sem|sobrenome7=em Authors list (ajuda)