Raio atómico
O raio atômico (português brasileiro) ou raio atómico (português europeu) é uma estimativa de distância do núcleo à última camada eletrônica. Ao contrário do que se poderia pensar, o raio atômico não depende apenas do peso do átomo e/ou da quantidade de elétrons presentes na eletrosfera, sendo fortemente influenciado pela carga nuclear efetiva (Zef) de cada elemento.[1][2][3]
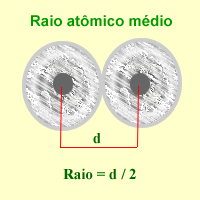
Numa explicação simplificada, o raio atômico é a distância entre o centro do átomo e a sua camada de valência, que é o nível de energia com elétrons mais externo deste átomo. Como consequência do átomo não ser rígido é impossível calcular o seu raio atômico exato. Deste modo, calcula-se o seu raio atômico médio.[1]
Devido a dificuldade em obter-se o raio de átomos isolados determina-se (através de raio X) a distância entre os núcleos de dois átomos ligados do mesmo elemento, no estado gasoso. O raio atômico será metade da distância calculada.
Tendências Periódicas nos Raios Atômicos
editar- Ao descermos nos grupos da tabela periódica, o número atômico (Z) cresce. Isto resulta basicamente do aumento do número quântico principal (n) dos elétrons mais externos, consequentemente aumentando o número de camadas e a distância entre o núcleo e a camada eletrônica mais externa, resultando no aumento do tamanho do átomo;
- Deslocando-se da esquerda para direita em um mesmo período da tabela periódica, observamos a diminuição do raio atômico. Esta tendência ocorre devido ao aumento da carga nuclear efetiva (Zef) à medida que nos deslocamos no período. O aumento da quantidade de prótons no núcleo resulta em um aumento da carga nuclear efetiva, atraindo os elétrons(inclusive os mais externos) aproximando-os do núcleo, resultando assim na redução do raio atômico.
Propriedades
editarOs núcleos atômicos encontram-se, em condições normais, no seu estado fundamental. Algumas propriedades observáveis podem ser extraídas desses núcleos. O raio nuclear é uma das propriedades mais fáceis de observar e pode ser obtido a partir de experiências de dispersão como as realizadas por Rutherford. Como base nessas experiências, percebeu-se que era uma boa aproximação considerar o raio nuclear R como relacionado à massa nuclear pela expressão
Onde . O raio nuclear determina a forma da distribuição angular, a partir da qual se pode então calculá-lo.[4]
Partículas Alfa
editarUma experiência de espalhamento elástico envolvendo núcleos pesados foi feita em 1954 por Farwell e Wegner. Com energia intermediária de 13 a 43 MeV usando um cíclotron de 60 polegadas.
O resultado obtido envolvendo uma amostra de Pb (chumbo) a 60º esta reproduzido na figura. A curva de Coulomb corrigida está normalizada pelos dados experimentais de baixa energia. Esta curva segue aproximadamente a dependência com o inverso do quadrado da seção de choque de Coulomb (Rutherford) com a energia, mas está levemente alterada a fim de levar em conta pequenas variações do ângulo de espalhamento com a energia devido ao campo magnético do cíclotron.[4]
Em baixas energias observa-se a teoria do espalhamento de Rutherford correta; porém, a partir de energias por volta de 27 MeV, com o aumento da energia de partícula alfa, a seção do choque cai rapidamente, obrigando a partir disso a adotar outros modelos a fim de explicar a aproximação da partícula alfa do núcleo atômico.
Tendo essas dúvidas em cheque, os cientistas Farwell e Wegner baseados em um modelo apresentado por Blair, que explicava as absorções de partículas alfa pelo núcleo.
Blair supôs que a soma dos raios nuclear com a partícula alfa seria aproximadamente igual à distância de máxima aproximação calculada na energia para a qual a seção de choque experimental é 1/4 da seção de choque Coulomb. Tendo a expressão:
Onde D1/4 é a distância de máxima aproximação, Rn é o raio do núcleo e R α.
Raio atômico medido empiricamente
editarO raio atômico pode ser medido empiricamente em picômetros (pm) com uma precisão aproximada de 5 pm.[5]
| Grupo (vertical) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Período (horizontal) | |||||||||||||||||||
| 1 | H 25 |
He | |||||||||||||||||
| 2 | Li 145 |
Be 105 |
B 85 |
C 70 |
N 65 |
O 60 |
F 50 |
Ne | |||||||||||
| 3 | Na 180 |
Mg 150 |
Al 125 |
Si 110 |
P 100 |
S 100 |
Cl 100 |
Ar 71 | |||||||||||
| 4 | K 220 |
Ca 180 |
Sc 160 |
Ti 140 |
V 135 |
Cr 140 |
Mn 140 |
Fe 140 |
Co 135 |
Ni 135 |
Cu 135 |
Zn 135 |
Ga 130 |
Ge 125 |
As 115 |
Se 115 |
Br 115 |
Kr | |
| 5 | Rb 235 |
Sr 200 |
Y 180 |
Zr 155 |
Nb 145 |
Mo 145 |
Tc 135 |
Ru 130 |
Rh 135 |
Pd 140 |
Ag 160 |
Cd 155 |
In 155 |
Sn 145 |
Sb 145 |
Te 140 |
I 140 |
Xe | |
| 6 | Cs 260 |
Ba 215 |
* |
Hf 155 |
Ta 145 |
W 135 |
Re 135 |
Os 130 |
Ir 135 |
Pt 135 |
Au 135 |
Hg 150 |
Tl 190 |
Pb 180 |
Bi 160 |
Po 190 |
At |
Rn | |
| 7 | Fr |
Ra 215 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanídios | * |
La 195 |
Ce 185 |
Pr 185 |
Nd 185 |
Pm 185 |
Sm 185 |
Eu 185 |
Gd 180 |
Tb 175 |
Dy 175 |
Ho 175 |
Er 175 |
Tm 175 |
Yb 175 |
Lu 175 | |||
| Actinídios | ** |
Ac 195 |
Th 180 |
Pa 180 |
U 175 |
Np 175 |
Pu 175 |
Am 175 |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
Raio atômico calculado
editarRaio atômico calculado em picômetros (pm)
| Grupo (vertical) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Período (horizontal) | |||||||||||||||||||
| 1 | H 53 |
He 31 | |||||||||||||||||
| 2 | Li 167 |
Be 112 |
B 87 |
C 67 |
N 56 |
O 48 |
F 42 |
Ne 38 | |||||||||||
| 3 | Na 190 |
Mg 145 |
Al 118 |
Si 111 |
P 98 |
S 88 |
Cl 79 |
Ar 71 | |||||||||||
| 4 | K 243 |
Ca 194 |
Sc 184 |
Ti 176 |
V 171 |
Cr 166 |
Mn 161 |
Fe 156 |
Co 152 |
Ni 149 |
Cu 145 |
Zn 142 |
Ga 136 |
Ge 125 |
As 114 |
Se 103 |
Br 94 |
Kr 88 | |
| 5 | Rb 265 |
Sr 219 |
Y 212 |
Zr 206 |
Nb 198 |
Mo 190 |
Tc 183 |
Ru 178 |
Rh 173 |
Pd 169 |
Ag 165 |
Cd 161 |
In 156 |
Sn 145 |
Sb 133 |
Te 123 |
I 115 |
Xe 108 | |
| 6 | Cs 298 |
Ba 253 |
* |
Hf 208 |
Ta 200 |
W 193 |
Re 188 |
Os 185 |
Ir 180 |
Pt 177 |
Au 174 |
Hg 171 |
Tl 156 |
Pb 154 |
Bi 143 |
Po 135 |
At |
Rn 120 | |
| 7 | Fr 270 |
Ra |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Lantanídios | * |
La |
Ce |
Pr 247 |
Nd 206 |
Pm 205 |
Sm 238 |
Eu 231 |
Gd 233 |
Tb 225 |
Dy 228 |
Ho |
Er 226 |
Tm 222 |
Yb 222 |
Lu 217 | |||
| Actinídios | ** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr | |||
Veja também
editarReferências
- ↑ a b Júlio César Lima Lira (17 de junho de 2010). «Raio Atômico»
- ↑ CrystalMaker Software Ltd. «Elements, Atomic Radii and the Periodic Table». Arquivado do original em 17 de maio de 2013
- ↑ Brown, T. L. Química A Ciência Central. Pearson São Paulo. 9ª Edição, 2012. Página 222 e 223
- ↑ a b K. C. Chung (2009). Introdução à Física Nuclear 1 ed. [S.l.]: UERJ. p. 285. ISBN 9788575110157
- ↑ Slater, J.C (2007). Introduction To Chemical Physics (em inglês). [S.l.]: Martindell Press. p. 536. ISBN 978-1406717594